Wie aus der Gesundheits-App eine vermarktbare digitale Gesundheitsanwendung (DiGA) wird – Teil 2
Veröffentlicht am 1st Dezember 2020
„App auf Rezept“: Digitale Gesundheitsanwendungen auf der Überholspur in die Regelversorgung der gesetzlichen Krankenkassen
Im zweiten Teil unserer vierteiligen Serie „Wie aus der Gesundheits-App eine vermarktbare digitale Gesundheitsanwendung (DiGA) wird“, welche die Möglichkeiten und Herausforderungen für Gesundheits-Apps in Deutschland behandelt, beleuchtet Larissa Mößmer die Chancen und wesentlichen Voraussetzungen einer Gesundheits-App als sog. digitale Gesundheitsanwendung (DiGA) auf dem Weg in die Erstattungsfähigkeit durch die gesetzlichen Krankenversicherungen (GKV).
Es herrscht Goldgräberstimmung unter den Entwicklern von Gesundheits-Apps in Deutschland: Die „App auf Rezept“ ist da! Am 19. Dezember 2019 trat das Digitale-Versorgung-Gesetz (DVG) in Kraft und ebnete den Weg bestimmter Gesundheits-Apps in die Regelversorgung der GKV und damit den Zugang zum öffentlichen Gesundheitswesen in Deutschland, einem der größten Gesundheitsmärkte der Welt.
Mussten die Kosten für entsprechende medizinische Anwendungen bislang größtenteils von den Nutzern selbst getragen werden, so haben nun ca. 73 Millionen gesetzlich Versicherte einen Anspruch auf Versorgung mit digitalen Gesundsheitsanwendungen (DiGAs), also bestimmten medizinischen Apps, die von Ärzten und Psychotherapeuten in Deutschland – als weltweit erstem Land – auf Kassenkosten verordnet werden können.
Rechtsrahmen: Normen-Dreiklang zur Regelung der Zulassung und Erstattung von DiGAs
Die in Umsetzung des DVG neu geschaffenen § 33a und § 139e des Fünften Buches Sozialgesetzbuch (SGB V), schaffen erstmals einen Regulierungsrahmen für die Zulassung und Erstattung dieser „Apps auf Rezept“. So enthält § 33a Abs. 1 SGB V nunmehr den Anspruch des Versicherten auf Versorgung mit digitalen Gesundheitsanwendungen, wenn diese die Voraussetzungen und das Verfahren zur Aufnahme in das vom Bundesamt für Arzneimittel und Medizinprodukte (BfArM) geführte Verzeichnis für digitale Gesundheitsanwendungen (DiGA-Verzeichnis) gemäß § 139e SGB V erfüllen und vom Arzt oder Psychotherapeuten verordnet beziehungsweise von der Krankenkasse genehmigt wurden.
Flankiert werden diese Bestimmungen des SGB V durch die sog. Digitale-Gesundheitsanwendungen-Verordnung (DiGAV), welche am 21. April 2020 in Kraft trat und die Einzelheiten zu materiellen Anforderungen von DiGAs und zum sog. Fast-Track-Verfahren für die Aufnahme in das DiGA-Verzeichnis sowie der Erstattungsfähigkeit dieser DiGAs konkretisiert.
Abgerundet wird der Normen-Dreiklang durch den sog. „DiGA-Leitfaden“, eine ebenfalls Ende 2020 vom BfArM erlassene erläuternde Auslegungshilfe für die materiellen Kriterien und prozeduralen Vorgaben des DVG und der DiGAV zum Fast-Track-Verfahren. Mit Erlass dieses Leitfadens setzte das BfArM das Schlussstück für den neuen Rechtsrahmen und den Auftakt für dessen Umsetzung.
Rechtliche Anforderungen einer DiGA: Welche Apps fallen darunter und welche nicht?
Am Anfang des Wegs einer Gesundheits-App in die Regelversorgung der gesetzlichen Krankenkassen stellt sich zunächst die Frage, welche Apps überhaupt DiGAs, also digitale Gesundheitsanwendungen im Sinne des DVG darstellen und welche von vornherein aus dem Rahmen einer möglichen Erstattung herausfallen.
Die in § 33a Abs. 1 S. 1 SGB V enthaltene Legaldefinition beschreibt die rechtlichen Anforderungen einer DiGA wie folgt:
„[Digitale Gesundheitsanwendungen sind Medizinprodukte] niedriger Risikoklasse, deren Hauptfunktion wesentlich auf digitalen Technologien beruht und die dazu bestimmt sind, bei den Versicherten oder in der Versorgung durch Leistungserbringer die Erkennung, Überwachung, Behandlung oder Linderung von Krankheiten oder die Erkennung, Behandlung, Linderung oder Kompensierung von Verletzungen oder Behinderungen zu unterstützen (digitale Gesundheitsanwendungen).“
Nach der Konzeption des Gesetzgebers soll die DiGA somit als „digitaler Helfer“ in der Hand des Patienten dienen, weshalb Apps der reinen Praxisausstattung nicht von dem Begriff umfasst werden.
Medizinprodukt niedriger Risikoklasse (Klasse I oder IIa)
Maßgebliches Ausgangskriterium einer DiGA ist zunächst deren Zertifizierung als Medizinprodukt einer niedrigen Risikoklasse I oder IIa nach der EU-Verordnung über Medizinprodukte (MDR) beziehungsweise bis zu deren Geltungsbeginn am 26. Mai 2021, im Rahmen der Übergangsvorschriften nach der Medizinprodukterichtlinie 93/42/EWG (MDD).
Besonders zu beachten ist diesbezüglich der Verweis in § 33a Abs. 2 SGB V auf die Anwendung der Übergangsbestimmungen der MDR. So können nach § 120 Abs. 3 und 4 MDR Medizinprodukte, die bereits ein gültiges Zertifikat entsprechend der MDD tragen und die den Anforderungen der MDD ab dem Tag des Geltungsbeginns der MDR am 26. Mai 2021 weiterhin entsprechen, noch auf Basis der alten Risikoklassifizierung in den Verkehr gebracht werden.
Warum sich hinter dieser Übergangsbestimmung ein echter Wettbewerbsvorteil für „first mover“ verbirgt und es sich daher lohnt, eine Gesundheits-App noch vor Mai 2021 als Medizinprodukt zu zertifizieren, sowie Näheres zur Einordnung als Medizinprodukt niedriger Risikoklasse lesen Sie in Teil 1 unserer vierteiligen Beitragsserie.
Hauptfunktion basierend auf digitalen Technologien
Weitere Voraussetzung ist, dass die Hauptfunktion der DiGA wesentlich auf digitalen Technologien beruht, ihr medizinischer Zweck also gerade durch die digitale Hauptfunktion erreicht wird. Daher reicht beispielsweise die digitale Eröffnung eines Kommunikationskanals (via Video, Chat) zwischen Arzt und Patient nicht aus, sondern die „intelligenten“ Algorithmen der Software müssen selbst eine unmittelbare medizinische Funktion erfüllen. Daher können zwar grundsätzlich sowohl eine native App als auch eine Desktop- oder Browseranwendung eine DiGA sein, allerdings darf die Anwendung nicht lediglich der Auslesung anderer Geräte und der Übermittlung von Daten dienen, sondern es muss eine Analyse und Aufbereitung der Daten durch die Software erfolgen.
Vielfach kritisiert wurde im Hinblick auf dieses Kriterium die schwierige Trennbarkeit zwischen dem Vorliegen einer erstattungsfähigen DiGA und eines nicht erstattungsfähigen Kombinationsprodukts. In dem DiGA-Leitfaden des BfArM wurden diesbezüglich daher weitergehende Erläuterungen aufgenommen. Danach sind neben der Software auch Geräte, Sensoren oder andere Hardware (z.B. Wearables) als DiGA zu klassifizieren, so lange (1) die Hauptfunktion eine überwiegend digitale ist, (2) die Hardware für die Erreichung des Zwecks der DiGA notwendig ist und es sich (3) nicht um privat zu finanzierende Gegenstände des täglichen Lebens handelt, wie beispielsweise ein Smartphone zur Umsetzung der durch die DiGA angeleiteten Übungen.
Ausschluss von primärpräventiven Anwendungen und Life-Style-Apps
Aufgrund der in § 33a Abs. 1 SGB V geregelten Zweckbestimmung einer DiGA zur Unterstützung der „Erkennung, Überwachung, Behandlung oder Linderung von Krankheiten“ oder der „Erkennung, Behandlung, Linderung oder Kompensierung von Verletzungen oder Behinderungen“ werden reine „Life-Style-Apps“, also Apps, die lediglich der Förderung eines gesunden Lebensstils im Allgemeinen dienen (z.B. Fitness-Tracker, Kalorienzähler) sowie rein primärpräventive digitale Anwendungen von vornherein aus dem erstattungsfähigen Rahmen ausgeklammert.
Dagegen werden Apps, die dazu beitragen, die Verschlechterung eines Krankheitszustandes zu verhindern (Sekundärprävention) oder Folgeerkrankungen und Komplikationen (Tertiärprävention) zu vermeiden, mit dem Begriff der „Behandlung“ von der gesetzlichen Definition einer DiGA erfasst.
Der Weg in die Erstattungsfähigkeit: Der „Fast-Track“ zur Aufnahme in das DiGA-Verzeichnis
Voraussetzung für die Erstattung einer DiGA durch die GKV ist deren erfolgreiches Durchlaufen eines zügigen Prüfverfahrens vor dem BfArM, dem sog. Fast-Track-Verfahren, und die anschließende Listung der App im DiGA-Verzeichnis.
Überblick des Fast-Track-Verfahrens vor dem BfArM
Das Fast-Track-Verfahren ist in den §§ 1 ff. der DiGAV geregelt und beginnt mit einem beim BfArM zu stellenden Antrag auf Aufnahme in das DiGA-Verzeichnis durch den Hersteller oder eines von diesem ordnungsgemäß bevollmächtigten Dritten. In den darauffolgenden drei Monaten prüft das BfArM, ob es sich bei der App um eine DiGA im Sinne des § 33a SGB V nach den oben dargestellten Kriterien handelt und ob diese die in § 139e Abs. 2 SGB V geregelten Anforderungen zur Aufnahme in das DiGA-Verzeichnis erfüllt sowie abschließend, ob etwaige Ausschlussgründe gegen eine solche Aufnahme bestehen.
Kern des Verfahrens ist dabei die Prüfung der Produktanforderungen an Sicherheit, Funktionstauglichkeit, Qualität, Datenschutz und Datensicherheit (Näheres hierzu in Teil 3 unserer vierteiligen Beitragsserie) sowie die Prüfung eines durch den Hersteller beizubringenden Nachweises für die mit der DiGA realisierbaren positiven Versorgungseffekte.
Nach erfolgreichem Durchlauf des Prüfverfahrens erfolgt die Aufnahme der App in das DiGA-Verzeichnis entweder endgültig oder, falls die DiGA zwar alle übrigen Prüfanforderungen erfüllt, jedoch noch keinen Nachweis positiver Versorgungseffekte vorlegen kann, zunächst vorübergehend für 12 Monate (maximal jedoch 24 Monate). Innerhalb dieser Erprobungsphase muss der Hersteller sodann die geforderten Evidenznachweise für das Vorliegen positiver Versorgungseffekte erbringen.
Die nachfolgende Grafik des BfArM veranschaulicht die wesentlichen Schritte des Fast-Track-Verfahrens zur Aufnahme in das DiGA-Verzeichnis:
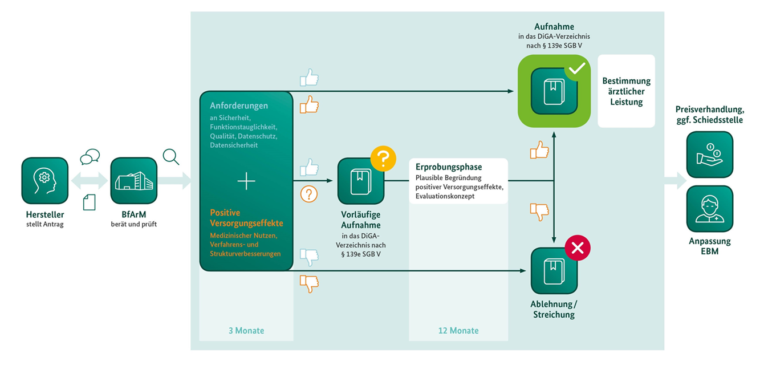
Quelle: BfArM, 2020, „Das Fast-Track-Verfahren für digitale Gesundheitsanwendungen (DiGA) nach § 139e SGB V. Ein Leitfaden für Hersteller, Leistungserbringer und Anwender“.
Begriff und Nachweis positiver Versorgungseffekte
Als vom Hersteller nachzuweisende „positive Versorgungseffekte“ im Sinne des § 8 DiGAV sind entweder ein medizinischer Nutzen oder patientenrelevante Struktur- und Verfahrensverbesserungen in der Versorgung zu verstehen. Medizinischer Nutzen ist danach der patientenrelevante Effekt hinsichtlich der Verbesserung des Gesundheitszustands, der Verkürzung der Krankheitsdauer, der Verlängerung des Überlebens oder einer Verbesserung der Lebensqualität, während patientenrelevante Struktur- und Verfahrensverbesserungen in der Versorgung auf eine Unterstützung des Gesundheitshandelns der Patienten oder eine Integration der Abläufe zwischen Patienten und Leistungserbringern ausgerichtet sind.
Beide Begriffe beziehen sich damit unmittelbar auf den Patienten selbst. Die Effekte einer DiGA auf die Arbeitslast von medizinischem Personal oder ökonomische Kennzahlen der Versorgung sind als nicht patientenrelevante Endpunkte somit nicht zum Nachweis positiver Versorgungseffekte geeignet, können jedoch im Rahmen der späteren Verhandlung über die Vergütung der DiGA mit dem GKV-Spitzenverband eine Rolle spielen.
Der Nachweis positiver Versorgungseffekte ist zwingend anhand einer retrospektiven oder prospektiven quantitativen Vergleichsstudie zu führen, welche zeigt, dass die Anwendung der digitalen Gesundheitsanwendung besser für die Patienten ist als deren Nichtanwendung. Die spezifischen Anforderungen an das konkrete Studiendesign werden in den §§ 10 ff. DiGAV sowie in dem konkretisierenden DiGA-Leitfaden des BfArM thematisiert und anhand zahlreicher Beispiele illustriert.
Aufnahme in das DiGA-Verzeichnis und Erstattung durch die GKV
Erfüllt die DiGA alle Prüfanforderungen und kann zum Zeitpunkt der Antragstellung bereits der Nachweis ihrer positiven Versorgungseffekte hinreichend durch entsprechende Studien geführt werden, so wird die DiGA endgültig in das DiGA-Verzeichnis aufgenommen.
Gelingt dieser Nachweis der positiven Versorgungseffekte nicht, so ist auf Antrag eine vorläufige Listung der DiGA für einen sog. Erprobungszeitraum von zunächst maximal 12 Monaten möglich, welcher einmalig um weitere zwölf Monate verlängert werden kann. Als Voraussetzung hierfür sieht §139e Abs. 4 SGB V vor, dass der Hersteller eine plausible Begründung des Beitrags der DiGA zur Verbesserung der Versorgung und ein von einer herstellerunabhängigen Institution erstelltes wissenschaftliches Evaluationskonzept zum Nachweis positiver Versorgungseffekte vorlegt. Innerhalb der Erprobungsphase muss der Hersteller dann allerdings die geforderten Evidenznachweise für das Vorliegen positiver Versorgungseffekte anhand entsprechender Studien erbringen.
Nach Aufnahme in das DiGA-Verzeichnis wird die DiGA schließlich ein Jahr lang vorläufig von der GKV zum tatsächlichen Herstellerpreis erstattet. Der Preis ab dem zweiten Jahr wird anschließend zwischen dem Hersteller und dem GKV-Spitzenverband ausgehandelt (Näheres hierzu lesen Sie in Teil 4 unserer vierteiligen Beitragsserie).
Ausblick
Auch wenn zum jetzigen Zeitpunkt die langfristigen Auswirkungen der noch sehr jungen gesetzlichen Neuregelungen zur Erstattungsfähigkeit digitaler Gesundheitsanwendung auf den deutschen Gesundheitsmarkt noch schwer abzuschätzen sind, so bestehen kaum Zweifel daran, dass der Markt durch das Fast-Track-Verfahren und der damit verbundenen Erleichterung von Marktzugang und Monetarisierung von Gesundheits-Apps einen enormen Schub erfahren wird.
Die nächsten Monate werden zeigen, ob das theoretisch als Fast-Track-Verfahren intendierte Rechtsregime praktikabel genug ist, um als solches den DiGAs einen schnellen Weg in die Regelversorgung der GKV zu ebnen.
Stand Ende November 2020 wurden bereits 40 Anträge beim BfArM auf Aufnahme in das DiGA-Verzeichnis gestellt von denen bislang fünf positiv und noch keiner negativ verbeschieden wurde. Das aktuelle Verzeichnis bereits endgültig oder vorläufig aufgenommener DiGA ist auf der Seite des BfArM öffentlich einzusehen.

Autorin: Larissa Mößmer (Associate bei Osborne Clarke)




